categorieën: Aanbevolen artikelen » Beginnende elektriciens
Aantal keer bekeken: 52646
Reacties op het artikel: 4
Transistors. Deel 2. Geleiders, isolatoren en halfgeleiders
Begin van het artikel: Transistor geschiedenis, Transistors: doel, apparaat en werkingsprincipes
 In de elektrotechniek worden verschillende materialen gebruikt. De elektrische eigenschappen van stoffen worden bepaald door het aantal elektronen in de buitenste valentiebaan. Hoe minder elektronen in deze baan zijn, hoe zwakker ze zijn geassocieerd met de kern, hoe gemakkelijker ze kunnen reizen.
In de elektrotechniek worden verschillende materialen gebruikt. De elektrische eigenschappen van stoffen worden bepaald door het aantal elektronen in de buitenste valentiebaan. Hoe minder elektronen in deze baan zijn, hoe zwakker ze zijn geassocieerd met de kern, hoe gemakkelijker ze kunnen reizen.
Onder invloed van temperatuurschommelingen breken de elektronen weg van het atoom en bewegen in de interatomaire ruimte. Dergelijke elektronen worden vrij genoemd en creëren een elektrische stroom in de geleiders. Is er een grote interatomaire ruimte, is er ruimte voor vrije elektronen om door de materie te reizen?
De structuur van vaste stoffen en vloeistoffen lijkt continu en dicht, doet denken aan de structuur van een bol draad. Maar in feite lijken zelfs vaste stoffen meer op een vis- of volleybalnet. Natuurlijk kan dit niet op huishoudelijk niveau worden onderscheiden, maar door nauwkeurige wetenschappelijke studies is vastgesteld dat de afstanden tussen de elektronen en de atoomkern veel groter zijn dan hun eigen dimensies.
Als de grootte van de atoomkern wordt weergegeven in de vorm van een bal de grootte van een voetbal, dan zullen de elektronen in dit model de grootte van een erwt hebben, en elke dergelijke erwt bevindt zich vanaf de "kern" op een afstand van enkele honderden en zelfs duizenden meters. En tussen de kern en het elektron is leegte - er is gewoon niets! Als we de afstanden tussen de atomen van materie op dezelfde schaal voorstellen, zullen de dimensies überhaupt fantastisch zijn - tientallen en honderden kilometers!
Goede geleiders van elektriciteit zijn metalen. De atomen van goud en zilver hebben bijvoorbeeld slechts één elektron in de buitenste baan, daarom zijn ze de beste geleiders. IJzer geleidt ook elektriciteit, maar iets slechter.
Voer elektriciteit nog erger uit legeringen met hoge weerstand. Dit zijn nichrome, manganine, constantan, fechral en anderen. Zo'n verscheidenheid aan legeringen met hoge weerstand is te wijten aan het feit dat ze zijn ontworpen om verschillende problemen op te lossen: verwarmingselementen, rekstroken, referentieweerstanden voor meetinstrumenten en nog veel meer.
Om het vermogen van een materiaal om elektriciteit te geleiden te evalueren, is het concept van "Elektrische geleidbaarheid". De retourwaarde is weerstandsvermogen. In de mechanica komen deze concepten overeen met het soortelijk gewicht.
isolatorenzijn, in tegenstelling tot geleiders, niet geneigd elektronen te verliezen. Daarin is de binding van het elektron met de kern erg sterk, en er zijn bijna geen vrije elektronen. Meer precies, maar heel weinig. Tegelijkertijd zijn er in sommige isolatoren er meer en is hun isolatiekwaliteit dienovereenkomstig slechter. Het is voldoende om bijvoorbeeld keramiek en papier te vergelijken. Daarom kunnen isolatoren voorwaardelijk worden verdeeld in goed en slecht.
Het verschijnen van gratis ladingen, zelfs in isolatoren, is te wijten aan thermische trillingen van elektronen: onder invloed van hoge temperaturen verslechteren de isolerende eigenschappen, sommige elektronen slagen er nog steeds in om uit de kern te breken.
Evenzo zou de soortelijke weerstand van een ideale geleider nul zijn. Maar gelukkig is er geen dirigent: stel je voor hoe de wet van Ohm ((I = U / R) eruit zou zien met nul in de noemer !!! Afscheid van wiskunde en elektrotechniek.
En alleen bij een temperatuur van absoluut nul (-273,2 ° C) stoppen de thermische schommelingen volledig en wordt de slechtste isolator goed genoeg. Om numeriek te bepalen is "dit" slecht - gebruik het begrip weerstand goed. Dit is de weerstand in Ohm van een kubus met een randlengte van 1 cm, de weerstandsafmeting wordt verkregen in Ohm / cm. De specifieke weerstand van sommige stoffen is hieronder weergegeven.Geleidbaarheid is de wederkerigheid van de weerstand, is de maateenheid van Siemens, - 1Sm = 1 / Ohm.
Ze hebben een goede geleidbaarheid of een lage soortelijke weerstand: zilver 1,5 * 10 ^ (- 6), lees hoe (anderhalf tot tien voor het vermogen min zes), koper 1,78 * 10 ^ (- 6), aluminium 2,8 * 10 ^ (- 6). De geleidbaarheid van legeringen met hoge weerstand is veel slechter: constantan 0,5 * 10 ^ (- 4), nichrome 1,1 * 10 ^ (- 4). Deze legeringen kunnen slechte geleiders worden genoemd. Vervang na al deze complexe getallen Ohm / cm.
Verder kunnen halfgeleiders worden onderscheiden als een afzonderlijke groep: germanium 60 Ohm / cm, silicium 5000 Ohm / cm, selenium 100.000 Ohm / cm. De weerstand van deze groep is groter dan die van slechte geleiders, maar minder dan die van slechte isolatoren en niet te vergeten goede. Waarschijnlijk zouden halfgeleiders met hetzelfde succes semi-isolatoren kunnen worden genoemd.
Na zo'n korte kennismaking met de structuur en eigenschappen van een atoom, zou men moeten overwegen hoe atomen met elkaar omgaan, hoe atomen met elkaar omgaan, hoe moleculen ervan worden gemaakt, waaruit verschillende stoffen worden samengesteld. Om dit te doen, moet je opnieuw de elektronen in de buitenste baan van het atoom onthouden. Zij zijn het immers die deelnemen aan de binding van atomen in moleculen en de fysische en chemische eigenschappen van materie bepalen.
Hoe atomen worden gemaakt van atomen
Elk atoom bevindt zich in een stabiele toestand als er 8 elektronen in zijn buitenste baan zijn. Hij probeert geen elektronen van naburige atomen te nemen, maar hij geeft zijn eigen niet op. Om dit te verifiëren, volstaat het in het periodiek systeem om naar inerte gassen te kijken: neon, argon, krypton, xenon. Elk van hen heeft 8 elektronen in de buitenste baan, wat de terughoudendheid van deze gassen verklaart om relaties (chemische reacties) met andere atomen aan te gaan, om moleculen van chemicaliën te bouwen.
De situatie is heel anders voor die atomen die geen 8 gekoesterde elektronen in hun buitenste baan hebben. Dergelijke atomen geven er de voorkeur aan zich te verenigen met anderen om hun buitenste baan met maximaal 8 elektronen aan te vullen en een rustige, stabiele toestand te vinden.
Bijvoorbeeld het bekende watermolecuul H2O. Het bestaat uit twee waterstofatomen en een zuurstofatoom, zoals weergegeven in de figuur. 1.
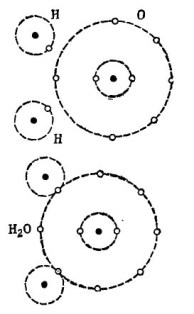
afbeelding 1. Hoe een watermolecuul wordt gemaakt.
In het bovenste deel van de figuur worden twee waterstofatomen en één zuurstofatoom afzonderlijk weergegeven. Er zijn 6 elektronen in de buitenste baan van zuurstof en twee elektronen op twee waterstofatomen zijn in de buurt. Zuurstof totdat het gekoesterde nummer 8 slechts twee elektronen in de buitenste baan mist, die hij zal ontvangen door twee waterstofatomen aan zichzelf toe te voegen.
Elk waterstofatoom mist 7 elektronen in zijn buitenste baan voor volledig geluk. Het eerste waterstofatoom ontvangt in zijn buitenste baan 6 elektronen van zuurstof en een ander elektron van zijn tweeling - het tweede waterstofatoom. Er zijn nu 8 elektronen in zijn buitenste baan samen met zijn elektron. Het tweede waterstofatoom voltooit ook zijn buitenste baan tot het gekoesterde nummer 8. Dit proces wordt getoond in het onderste deel van de figuur. 1.
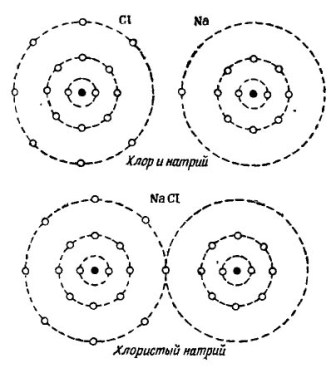
Op de foto 2 Het proces van het combineren van natrium- en chlooratomen wordt getoond. Het resultaat is natriumchloride, dat wordt verkocht in winkels die zout worden genoemd.
afbeelding 2. Het proces van het combineren van natrium- en chlooratomen
Ook hier ontvangt elk van de deelnemers het ontbrekende aantal elektronen van de andere: chloor hecht een enkel natriumelektron aan zijn eigen zeven elektronen, terwijl het zijn atomen aan het natriumatoom geeft. Beide atomen in de buitenste baan hebben 8 elektronen, waar volledige overeenstemming en voorspoed worden bereikt.
Valency van atomen
Atomen met 6 of 7 elektronen in hun buitenste baan hebben de neiging om 1 of 2 elektronen aan zichzelf te hechten. Ze zeggen over zulke atomen dat ze één of tweewaardig zijn. Maar als in de buitenste baan van een atoom 1, 2 of 3 elektronen, dan heeft zo'n atoom de neiging ze weg te geven. In dit geval wordt het atoom als één, twee of driewaardig beschouwd.
Als er 4 elektronen in de buitenste baan van een atoom zitten, geeft een dergelijk atoom de voorkeur om te combineren met dezelfde, die ook 4 elektronen heeft. Dit is de combinatie van germanium- en siliciumatomen die worden gebruikt bij de productie van transistoren. In dit geval worden de atomen tetravalent genoemd. (De atomen van germanium of silicium kunnen worden gecombineerd met andere elementen, bijvoorbeeld zuurstof of waterstof, maar deze verbindingen zijn niet interessant in het plan van ons verhaal.)
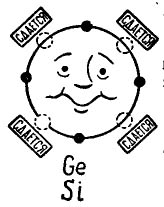
Op de foto 3 er wordt een germanium- of siliciumatoom getoond dat met hetzelfde atoom wil combineren. Kleine zwarte cirkels zijn de eigen elektronen van het atoom en lichte cirkels geven de plaatsen aan waar de elektronen van de vier atomen - buren - vallen.
afbeelding 3. Atoom van germanium (silicium).
De kristalstructuur van halfgeleiders
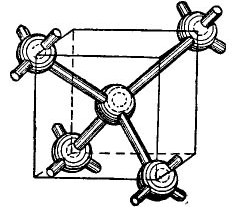
De germanium- en siliciumatomen in het periodiek systeem zijn in dezelfde groep als koolstof (de chemische formule van diamant C is eenvoudig grote koolstofkristallen die onder bepaalde omstandigheden worden verkregen) en vormen daarom, wanneer gecombineerd, een diamantachtige kristallijne structuur. De vorming van een dergelijke structuur wordt in een vereenvoudigde, natuurlijk vorm in de figuur getoond 4.
afbeelding 4.
In het midden van de kubus bevindt zich een germaniumatoom en in de hoeken bevinden zich nog 4 atomen. Het atoom afgebeeld in het midden van de kubus wordt door zijn valentie-elektronen aan zijn dichtstbijzijnde buren gebonden. Op hun beurt geven de hoekige atomen hun valentie-elektronen aan het atoom in het midden van de kubus en zijn buren - atomen niet weergegeven in de figuur. Aldus worden de buitenste banen aangevuld met maximaal acht elektronen. Natuurlijk is er geen kubus in het kristalrooster, het wordt alleen weergegeven in de figuur zodat de onderlinge, volumetrische ordening van atomen duidelijk is.
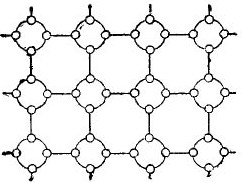
Maar om het verhaal over halfgeleiders zoveel mogelijk te vereenvoudigen, kan het kristalrooster worden weergegeven in de vorm van een platte schematische tekening, ondanks het feit dat de interatomaire verbindingen zich toch in de ruimte bevinden. Een dergelijke schakeling is weergegeven in de figuur. 5.
afbeelding 5. Het germaniumkristalrooster in een vlakke vorm.
In een dergelijk kristal zijn alle elektronen stevig bevestigd aan de atomen door hun valentiebindingen, daarom zijn er blijkbaar eenvoudig geen vrije elektronen. Het blijkt dat er voor ons een isolator in de figuur zit, omdat er geen vrije elektronen in zitten. Maar in feite is dit niet zo.
Intrinsieke geleidbaarheid
Het is een feit dat sommige elektronen er nog steeds in slagen om onder invloed van de temperatuur van hun atomen af te breken en zich enige tijd vrij te maken van de binding met de kern. Daarom bestaat er een kleine hoeveelheid vrije elektronen in een germaniumkristal, waardoor het mogelijk is om een elektrische stroom te geleiden. Hoeveel vrije elektronen bestaan er in een germaniumkristal onder normale omstandigheden?
Er zijn niet meer dan twee van dergelijke vrije elektronen per 10 ^ 10 (tien miljard) atomen, daarom is germanium een slechte geleider, of zoals de halfgeleider gebruikelijk is om te zeggen. Opgemerkt moet worden dat slechts één gram germanium 10 ^ 22 (tien miljard miljard miljard) atomen bevat, waarmee u ongeveer tweeduizend miljard vrije elektronen kunt "krijgen". Het lijkt genoeg om een grote elektrische stroom door te laten. Om dit probleem aan te pakken, volstaat het eraan te herinneren wat een stroom van 1 A.
Een stroom van 1 A komt overeen met het in één seconde door een geleider leiden van een elektrische lading van 1 Coulomb, of 6 * 10 ^ 18 (zes miljard miljard) elektronen per seconde. Tegen deze achtergrond is het onwaarschijnlijk dat tweeduizend miljard vrije elektronen, en zelfs verspreid over een enorm kristal, zorgen voor de doorgang van hoge stromen. Hoewel, als gevolg van thermische beweging, kleine geleidbaarheid bestaat in Duitsland. Dit is de zogenaamde intrinsieke geleidbaarheid.
Elektronische en gatgeleidbaarheid
Naarmate de temperatuur stijgt, wordt extra energie overgedragen aan de elektronen, hun thermische trillingen worden energieker, waardoor sommige elektronen uit hun atomen slagen te breken.Deze elektronen worden vrij en maken, bij afwezigheid van een extern elektrisch veld, chaotische bewegingen en bewegen in de vrije ruimte.
Atomen die elektronen hebben verloren, kunnen geen willekeurige bewegingen maken, maar oscilleren slechts licht ten opzichte van hun normale positie in het kristalrooster. Dergelijke atomen, die elektronen hebben verloren, worden positieve ionen genoemd. We kunnen aannemen dat in plaats van elektronen die zijn afgescheurd van hun atomen, vrije ruimtes worden verkregen, die gewoonlijk gaten worden genoemd.
Over het algemeen is het aantal elektronen en gaten hetzelfde, dus een gat kan een elektron vangen dat zich in de buurt bevindt. Als gevolg hiervan wordt een atoom van een positief ion opnieuw neutraal. Het proces van het combineren van elektronen met gaten wordt recombinatie genoemd.
Op dezelfde frequentie worden elektronen gescheiden van atomen, daarom is het aantal elektronen en gaten voor een bepaalde halfgeleider gemiddeld gelijk aan, constant en afhankelijk van externe omstandigheden, in het bijzonder temperatuur.
Als een spanning wordt aangelegd op het halfgeleiderkristal, dan wordt de elektronenbeweging geordend, een stroom zal door het kristal vloeien vanwege zijn elektron- en gatgeleidbaarheid. Deze geleidbaarheid wordt intrinsiek genoemd, het werd al iets hoger genoemd.
Maar pure halfgeleiders met elektronische en gatgeleidbaarheid zijn niet geschikt voor de productie van diodes, transistoren en andere details, omdat de basis van deze apparaten de p-n (lees "pe-en") -verbinding is.
Om een dergelijke overgang te verkrijgen, zijn twee soorten halfgeleiders nodig, twee soorten geleidbaarheid (p - positief - positief, gat) en (n - negatief - negatief, elektronisch). Dit soort halfgeleiders worden verkregen door dotering, waardoor onzuiverheden worden toegevoegd aan pure germanium- of siliciumkristallen.
Hoewel de hoeveelheid onzuiverheden erg klein is, verandert hun aanwezigheid grotendeels de eigenschappen van de halfgeleider, waardoor u halfgeleiders met verschillende geleidbaarheid kunt krijgen. Dit wordt in het volgende deel van het artikel besproken.
Boris Aladyshkin, electro-nl.tomathouse.com
Zie ook op electro-nl.tomathouse.com
: